আয়নিক বন্ধনের মাধ্যমে কিভাবে KF ও Al2O3 নমক যৌগ গঠন করা যায়। ব্যাখ্যা কর ?
আয়নিক বন্ধন : ধাতব পরমাণু ও অধাতব পরমাণু ইলেকট্রন বর্জন ও গ্রহনের মাধ্যমে যে বন্ধন তৈরি করে তাকে আয়নিক বন্ধন বলা হয়।
নিচে KF এর বন্ধন গঠন কৌশল
চিহ্ন সহ বিশ্লেষণ করা হলো :
K ও F এর ইলেকট্রন বিন্যাস
নিম্নরূপ :
K(19)→1s22s22p63s23p64s1
F(9) ➡ 1s22s22p5
ইলেকট্রন বিন্যাস থেকে দেখা যাচ্ছে যে, K ও F এর শেষ কক্ষপথে ইলেকট্রন সংখ্যা যথাক্রমে 1টি ও 7 টি।
স্থিতিশীলতা অর্জনের জন্য K পরমাণু তার সর্বশেষ কক্ষপথের 1টি ইলেকট্রন বর্জন করে K+ আয়ন গঠন করে এবং F পরমাণু তার সর্বশেষ কক্ষপথে 1 টি ইলেকট্রন গ্রহণ করে F- আয়ন গঠন করে।
এদের আয়নিক সমীকরণ নিম্নরূপ :
K - e⟶K+-------------x2
F2+e ⟶2F-
一一一一一一一一一一一一一一一一
2K + F2 ⟶2K+ + 2F-
বা, 2K + F2 ⟶2KF
ড়ায়াগ্রাম
:
বিঃদ্রঃ KF এর উত্তম আয়নিক সমীকরণ নিম্নরূপ :
আরো জানুন,
নিচে Al2O3 এর বন্ধন গঠন কৌশল চিহ্ন সহ বিশ্লেষণ করা হলো :
Al2 ও
O3 এর ইলেকট্রন বিন্যাস নিম্নরূপ :
Al(13)→1s22s22p63s23p1
O(8) ➡ 1s22s22p4
ইলেকট্রন বিন্যাস থেকে দেখা যাচ্ছে যে, Al2 ও O3 এর শেষ কক্ষপথে ইলেকট্রন সংখ্যা যথাক্রমে 3টি ও 6 টি।
স্থিতিশীলতা অর্জনের জন্য Al
পরমাণু তার সর্বশেষ কক্ষপথের 3টি ইলেকট্রন বর্জন করে Al+ আয়ন গঠন করে এবং O পরমাণু
তার সর্বশেষ কক্ষপথে 2 টি ইলেকট্রন গ্রহণ করে O- আয়ন গঠন করে।
এদের আয়নিক সমীকরণ নিম্নরূপ :
অয়নিক সমীকরণ থেকে দেখা যাচ্ছে
যে, 2Al পরমানু 3টি করে মোট 6টি ইলেকট্রন বর্জন করে 2টি Al3+ আয়ন গঠন করে এবং 3টি O
পরমানু 2টি করে মোট 6টি ইলেকট্রন গ্রহন করে 3টি O2- আয়ন গঠন করে।
এই বিপরীদ ধর্মী আয়ন দুটি পরস্পর
স্থির বৈদ্যুতিক আকর্ষণ বল দ্বারা যুক্ত হয়ে Al2O3 নামক
আয়নিক যৌগ উৎপন্ন করে।
ড়ায়াগ্রাম
:


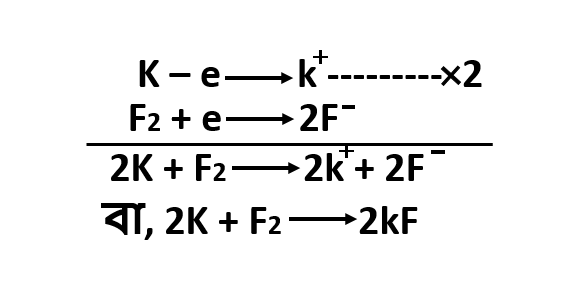
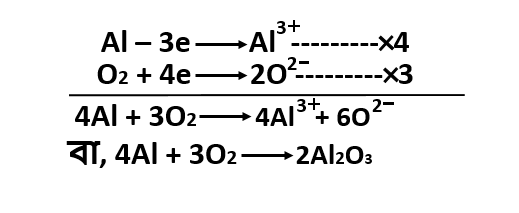

Post a Comment